Лекция№8. Уравнение Ван-Дер-Ваальса.
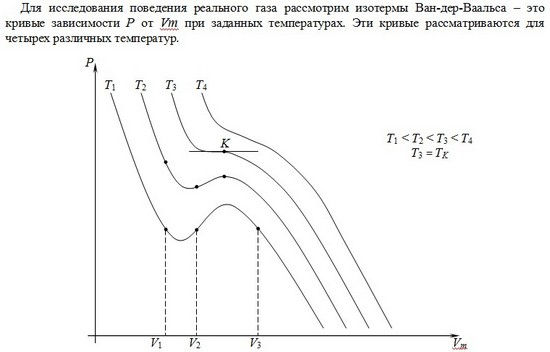
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, галандский физик Ван-дер-Ваальс вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона-Менделеева введены две поправки.
1) Учет собственного объема молекул, наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактически свободный объем, в котором может двигаться молекула реального газа, будет не Vm, а Vm – b, где b – объем, занимаемый собственными молекулами. Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находится две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние меньше диаметра молекул. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т.е. объем равный восьми объемам молекул, или учетверенному объему молекулы в расчете на одну молекулу.
2) Действие сил притяжения газа приводит к появлению давления на газ, называемого внутренним давлением...
Далее читайте в PDF, т.к. в тексте присутствую формулы и графики.
Читать онлайн:
Скачать с облака:
Облако.mail.ru: Запись только для зарегистрированных
Метки: Лекция, Молекулярная_физика_и_термодинамика Просмотров: 5170 Обсудить Подписаться на RSS
 Нужна помощь или консультация в проектировании инженерных систем: Отопление, Вентиляция, Водоснабжение, Канализация и газоснабжение?. Напишите свой вопрос через форму
обратной связи.
Нужна помощь или консультация в проектировании инженерных систем: Отопление, Вентиляция, Водоснабжение, Канализация и газоснабжение?. Напишите свой вопрос через форму
обратной связи.
Или закажите Kwork:
1. Проектирование отопления и вентиляции коттеджа
2. Расчёт системы отопления в программе audytor C.O.
3. Расчёт тепловых потерь
4. Консультация по системе отопления коттеджа
5. Консультация по системе вентиляции коттеджа


